人类抗癌之战重要转折点,CAR-T疗法获批上市!
[本文为疾病百科知识,仅供阅读] 发布日期:2017-11-01 阅读:1,917

8月30日,FDA官方网站宣布批准诺华CAR-T细胞疗法正式上市,用于改善复发性或难治性儿童、青少年B-细胞急性淋巴细胞白血病,其商品名为Kymriah(tisagenlecleucel)。
FDA称其为“一项历史性的行动,使美国种基因改善方法得以实现,从而采取了一种新的改善癌症、其他严重和危及生命的疾病的方法。”
FDA专员Scott Gottlieb博士说:“我们正在进入一个新的医疗创新前沿,能够重编病人自己的细胞来攻击致命的癌症,基因和细胞疗法等新技术能够在转化医学和改善许多难治性疾病方面创造拐点。FDA致力于帮助加快开发和审查有潜力挽救生命的突破性改善。”
今年果然是CAR-T疗法的大年。
在此前两天,吉利德Gilead与Kite制药联合宣布,双方董事会已经达成最终收购协议,吉利德将以每股180美元的现金价格收购Kite,溢价29%。该项交易金额约为119亿美元,预计整个交易将在2017年第四季度完成。
吉利德巨资出手拿下了CAR-T三巨头之一,传统药企与新兴技术的结合充满想象。
2017年7月12日,美国FDA肿瘤药物专家咨询委员会(ODAC)召开针对诺华(Novartis)CAR-T疗法CTL-019(tisagenlecleucel)的评估会议,最终以10:0的投票结果一致推荐批准此疗法上市,是为首次。
上述结果将促使FDA在10月3日前做出最终审批决定,其时业内认为获批上市基本没有悬念,绝大多数情况下,FDA都会听从专家咨询委员会的意见。
“咨询委员会小组成员一致赞成,使我们在实现首个批准的CAR-T细胞疗法道路上又迈进了一步。”诺华肿瘤CEO Bruno Striginibiaoshi表示,“诺华开拓了癌症改善的新领域。”
CAR-T是通过基因工程技术,人工改造肿瘤患者的T细胞,在体外大量培养后生成肿瘤特异性CAR-T细胞,再将其回输入患者体内用以攻击癌细胞。
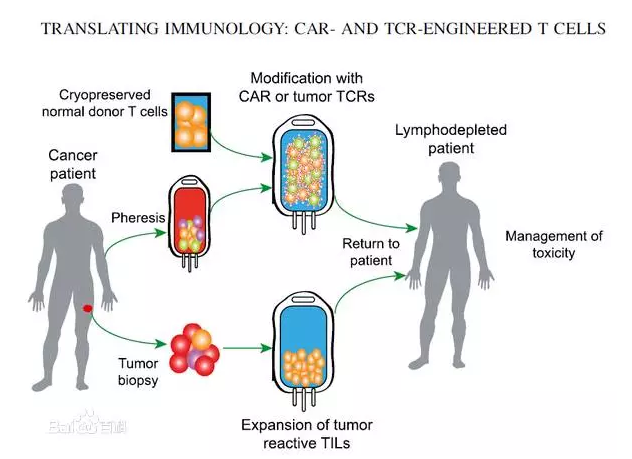
根据改善流程,CAR-T细胞免疫改善包括两大核心环节:一是用于制备CAR-T细胞的基因修饰载体的生产,即生产CAR慢病毒载体;二是CART细胞的制备和应用,包括采集患者的免疫细胞、体外细胞培养、转染、扩增和回输等制备和改善。
CTL019由宾夕法尼亚大学率先研发,在其嵌合抗原受体中用4-1BB共刺激域来增强细胞反应性以及CTL019注入患者后的持续疗效,可能有助于长时间缓解患者痛苦。
急性淋巴细胞白血病在15岁以下儿童癌症确诊病例中约占25%,是美国最常见的儿童癌。根据美国国家癌症研究所估计,每年约有3100名年龄在20岁以下的患者被诊断为这一疾病。有效的改善选择十分有限,在多次复发或难治性B-细胞急性淋巴细胞白血病儿童及青少年患者中,五年无病生存率低于10%-30%。
世界上例接受CAR-T疗法的小女孩Emily,在接受了16个月化疗后复发。2012年4月她开始接受CAR-T改善,为她改善的宾夕法尼亚大学细胞免疫疗法中心主任Carl June博士曾表示:“当时我们非常怀疑培养的T细胞能否对抗她体内的白血病癌细胞。”
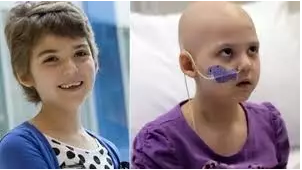
这位小女孩在5年后来到上述ODAC审评会现场,成为CTL019直接的疗效证据。
诺华的成功让业内沸腾,并将这一天称为“CAR-T日”,但患者和研发公司都曾面临巨大风险。
CAR-T是一种高度个性化的方法,每个人的细胞和接受过的改善都不同,如同Emily一样,许多患者在接受CAR-T改善前已经接受过各种改善方法,如骨髓移植手术、化疗、靶向改善等,所获得的T细胞的制备和编程也会各异。
此次获批公告中,FDA方面也表示,Kymriah的剂量是根据使用的患者自身T细胞所产生的定制改善。“患者的T细胞被收集并送到制造中心,在进行遗传修饰以包括含有特异性蛋白质(嵌合抗原受体或CAR)的新基因,其指导T细胞靶向并杀死具有表面上的特异性抗原(CD19)。一旦细胞被修饰,它们被注入到患者体内以杀死癌细胞。”
而在CAR-T研发梯队中,诺华一开始的卡位并不领先。但JUNO的 JACR015在去年的临床研究中先后出现5例脑水肿引起患者死亡;Kite的KTE-C19也在4月底出现1例患者死亡,两家先后折戟让诺华后来居上。
FDA的生物制剂评估中心总监Peter Marks博士说:“Kymriah是一种前所未有的改善方法,可满足儿童和年轻人对这种严重疾病的重要需求。Kymriah不仅为这些患者提供了一种新的改善方案,在极其有限的选择中,这也是一种在临床试验中显示出有希望缓解和存活率的改善方案。”
Kymriah的安全性和有效性在一项多中心临床试验中得到证实。改善三个月内的总体缓解率为83%。
但FDA提示用Kymriah改善有潜在的严重副作用。CAR-T改善过程中会释放出很多杀伤肿瘤细胞的细胞因子,副作用通常表现为发烧、低血压、脑水肿等,此前在评估会议上专家也提出诸多需要关注的问题,包括T细胞的制备、有效性,生产质控和安全性,癌症复发,毒副作用等。
推荐阅读:多睦健康|心血管疾病的最大克星 — DFPP血液净化疗法
本文链接地址:http://domo-kenkou.com/zixun/23.html