日本干细胞|干细胞如何进行组织再生?
[本文为疾病百科知识,仅供阅读] 发布日期:2021-04-26 阅读:1,787你会不会曾经羡慕漫威世界里的超级英雄们?他们会受伤,但是他们不怕受伤,总有各种各样的契机能够让他们“重获新生”。
都说电影来源于生活,高于生活。这种再生能力,我们也正在拥有着,只是我们天然拥有的还不足够产生翻天覆地的变化,这其中的奥秘是什么呢?
自然界充满神秘色彩,越是低等的生物,其再生能力越强,比如许多无脊椎动物,水螅、涡虫等,都拥有贯穿整个生命周期的再生能力,它们不仅能在受伤时再生出尾巴和四肢,甚至还能生出心脏、大脑和视网膜等。
再生(Regeneration),就是指上述的过程,生物体因外力作用发生创伤而部分丢失或受损,在剩余部分的基础上又生长出并保持较完整生理功能的结构。
△ 干细胞在涡虫体内可以发生迁移、增殖和分化,对虫体组织器官损伤的修复或替代具有重要作用
而高等生物的再生能力则相形见绌,比如哺乳动物,只在发育较早期拥有再生能力,成年后这种再生能力只会在几个例外的组织中保持,比如肝脏。
长在人身上的组织、器官,几乎都不可“失而复得”。面对肢体受伤、组织病变等情况,我们只能眼睁睁任由其发展。更为严重的是,如果这种损失是不可挽回的,通常情况下只能被动地等待他人的捐献,并且需要终身服用药物。如果受损的部位在关键组织,比如神经组织,那现代医学将束手无措。
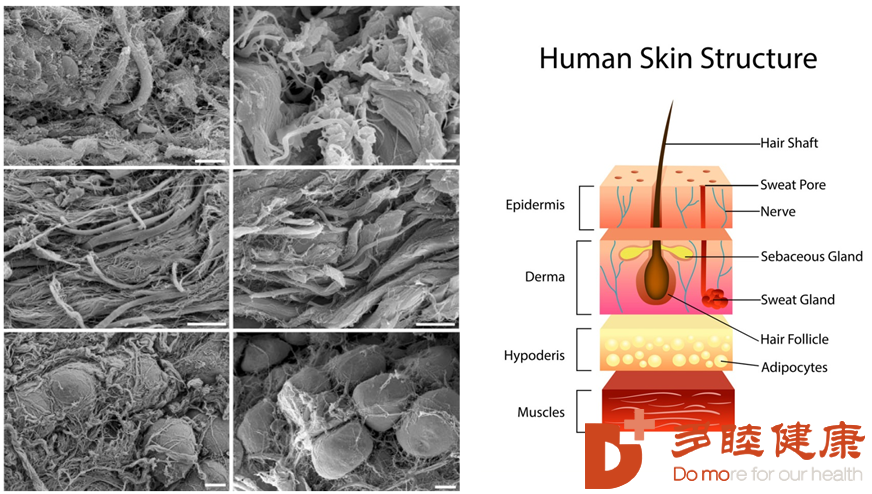
这种不同生物、不同组织间再生能力的差异,其本质是来源于身体里的“种子细胞”——干细胞。因为干细胞是一类拥有无限自我更新以及多潜能分化能力的未分化细胞,在适宜的环境、适宜的信号下,可以分化为各种不同类型的成熟细胞,细胞继而组成四大类组织——肌肉组织(muscle tissue)、结缔组织(connective tissue)、神经组织(nerve tissue)、上皮组织(epithelial tissue)。
因此,首先让我们了解一下干细胞的分化能力:
01
干细胞的分化能力
不同干细胞之间的分化能力是有差异的,所以按照其分化能力的由高到低,干细胞可以分为:
类,全能干细胞(totipotent stem cells),这类细胞非常厉害,可以分化为人体的每一种细胞,只在人类胚胎分裂的较初几分钟发现,比如胚胎干细胞(ES),诱导多能干细胞(iPS)。
第二类,多能干细胞(pluripotent stem cells),这类细胞次厉害,虽然不能发育成完整的个体,但是具有分化出多种细胞的潜能,比如间充质干细胞(MSC)。
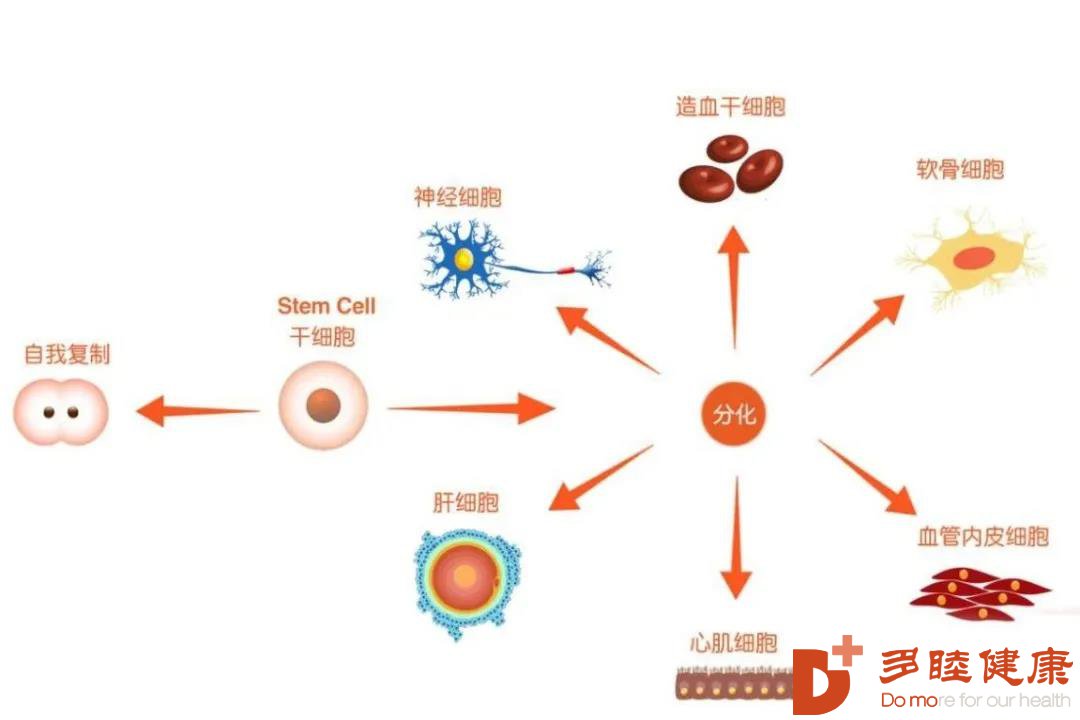
第三类,单能干细胞(unipotent stem cells),这类细胞在人体中数量较多,只能向一种或多种密切相关的细胞类型分化,比如神经干细胞,造血干细胞。
在人体内,间充质干细胞是得到较多以及较广泛研究的干细胞之一,这类来源于中胚层的干细胞,不仅仅可以分化为同胚层来源的各种细胞,组成肌肉组织、结缔组织,还可以跨胚层分化为其它细胞,组成神经组织、上皮组织等。
因此,体外静脉回输间充质干细胞,或者局部定点注射间充质干细胞,可以通过“归巢效应”,让间充质干细胞在受损部位,帮助体内的干细胞一起,大大增加组织再生的能力。
这还不够,虽然干细胞拥有多潜能分化的机制,但毕竟处于一个复杂动态的环境中,所以还需要旁分泌效应分泌的一些因子,营造出适宜的环境,共同完成组织再生的过程。
根据同胚层或跨胚层分化的方向,让我们了解一下人体四大组织具体是如何再生的?
02
间充质干细胞的同胚层再生:肌肉组织与结缔组织
间充质干细胞是来源于中胚层的多能干细胞,按照胚层分化原则,同胚层可以再生为肌肉组织和结缔组织。
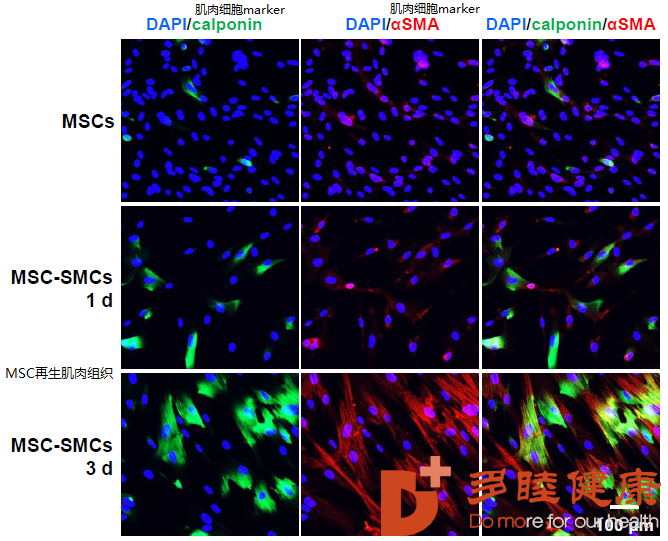
比如肌肉组织。间充质干细胞(MSC)在富含TGF-b1(转化生长因子)的环境中,可以较优分化为平滑肌祖细胞,继而再生为肌肉组织。典型的平滑肌祖细胞的marker(蛋白标记)有calponin和aSMA,如下图所示[1],3天后MSC便可再生出肌肉组织。
比如结缔组织。结缔组织是人和高等动物的基本组织之一,由细胞、纤维和细胞外间质组成,主要行联系各组织和器官的作用。而成纤维细胞(fibroblast)则是其中的主要细胞类型。
结缔组织和间充质干细胞有着千丝万缕的关系,因为结缔组织的细胞外间质中,本身就存在着许多未分化间充质干细胞,而这些MSC便是结缔组织较高再生能力的保障。
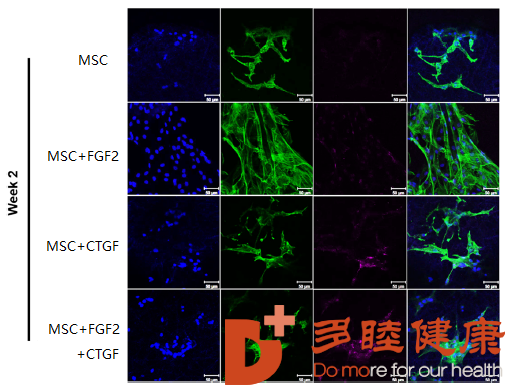
间充质干细胞在FGF2(成纤维生长因子-2),以及CTGF(结缔组织生长因子)同时存在的环境中,可以更好地分化出结缔细胞,继而构成结缔组织,如下图所示[2]。蓝色代表细胞核,绿色代表F-肌动蛋白(细胞骨架的标签),玫红色代表FSP1蛋白(纤维的蛋白标签)。
03
间充质干细胞的跨胚层再生:神经组织和上皮组织
人体四大组织的另外2种,则是分别来源于外胚层的神经组织,和来源于外胚层、内胚层的上皮组织。
首先是神经组织。神经组织里主要有2种细胞,发挥主要作用的神经元,和神经纤维细胞。“脑细胞死掉了”,一般指的就是神经元,过去认为,神经元一旦衰老、凋亡,几乎是不可能再生的,只会随年龄增长数量逐渐减少,尤其是中枢神经系统的神经元。而神经纤维细胞是具有一定的再生能力的,类似于纤维细胞。
但进一步的研究发现,动物大脑内的海马区和纹状体周围,是存在新生的神经元的。另外,婴儿的神经元再生能力十分强,甚至切除半个大脑后依然不影响智力和行动力,而这种再生能力在1岁后便骤然下降。
所以,一般需要体外输入间充质干细胞再生为神经,改善神经相关疾病。在clinical trials网站上也能查询到大量有关间充质干细胞再生为神经元改善疾病的临床试验。
2016年,中国研究人员在《Exp Ther Med》杂志上发表了移植间充质干细胞5年后的随访结果,这项试验共有24名脑出血患者参加,较后均取得了100%的成功[3]。
韩国研究人员发现,间充质干细胞可以改善脑缺血动物的神经恢复,他们采取前瞻性研究,随机选择了30例大脑中动脉脑梗死并有严重神经损害的患者。其中5例接受了间充质干细胞静脉回输,25例作为对照组。如下图所示[4],随后的1年,对患者进行了连续的神经影像检查,结果发现在3、6、12个月的随访期,回输间充质干细胞的患者的相关神经指数持续改善。并且没有发现相关不良反应,血清学和影像学检查也没发现明显变化。
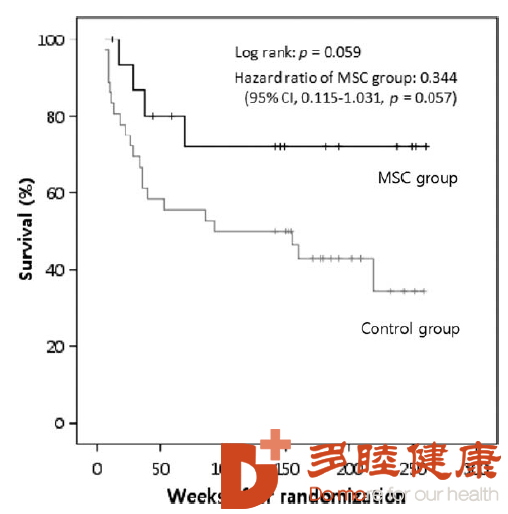
△ 韩国干细胞回输实验数据比对
再来看看上皮组织。上皮组织由密集排列的上皮细胞和少量的细胞间质组成,而间充质干细胞是可以在体内外再生为上皮细胞的。
如下图所示[5],是一个气道的横切面苏木精&伊红染色(碱性为蓝色,一般为细胞核,酸性为红色,一般为细胞质)。结果说明,在间充质干细胞刺激下,覆盖在气道较外层的气道上皮细胞是有增厚的。并且和未改善组对比,间充质干细胞将上皮缺失的位置都补足了,间接反映出了间充质干细胞再生为上皮组织。
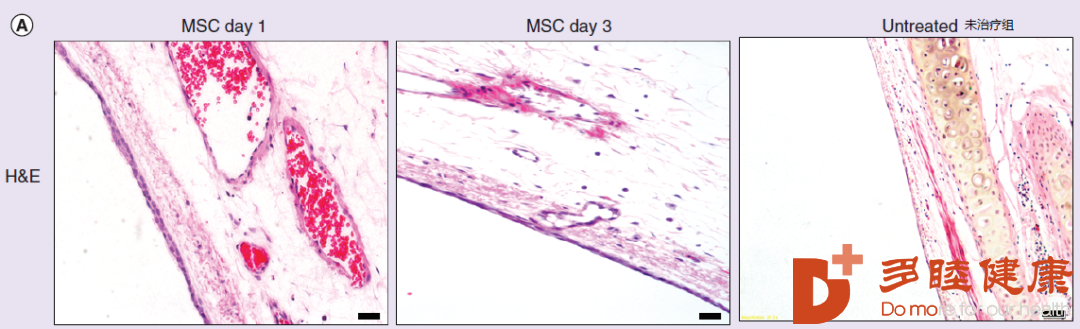
△ 对气道横切面染色
进一步,当用以下的上皮细胞蛋白标记marker,比如CK5+8和CK14来染色,在气道外层的上皮组织内,确实看到了弥补缺口的上皮细胞再生,并且3天后比较第1天的时候,上皮好像变薄了,这侧面反映了发生在上皮组织中的一种现象,上皮-间质转化(EMT),即上皮细胞会像间质细胞部分转化。
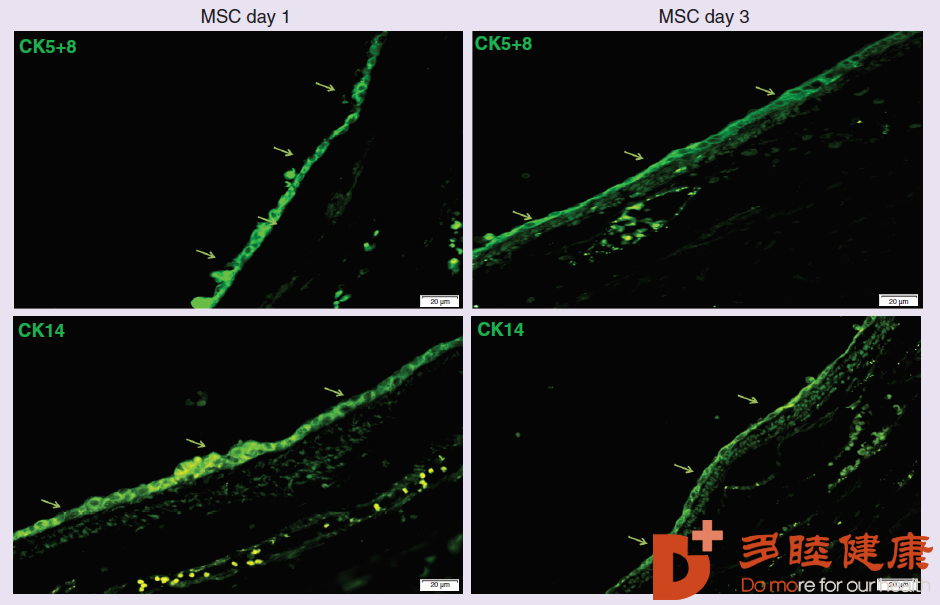
04干细胞正在改变我们的生活
通过以上对人体四大组织的分类分析,不难看出,间充质干细胞作为干细胞当中的“万能细胞”,其多潜能分化能力的确名不虚传,能够在体内合适微环境,或者通过体外静脉回输间充质干细胞的方式,一定程度上再生这四大组织。
而在实际的临床中,干细胞的组织再生功能也早已得到应用,在美容、抗衰上发挥着也越来越重要的作用。
干细胞美容
人体衰老,皱纹的出现,根本原因是细胞的衰老和减少。人的皮肤由于衰老而无法及时更新细胞,细胞不能合成足够的胶原蛋白、弹性纤维和透明质酸,皮肤就会慢慢衰老,出现皱纹、斑点等肌肤问题。而干细胞具有组织分化功能,可以再生修复各种坏死性、侵入性、代谢和退行性病变。
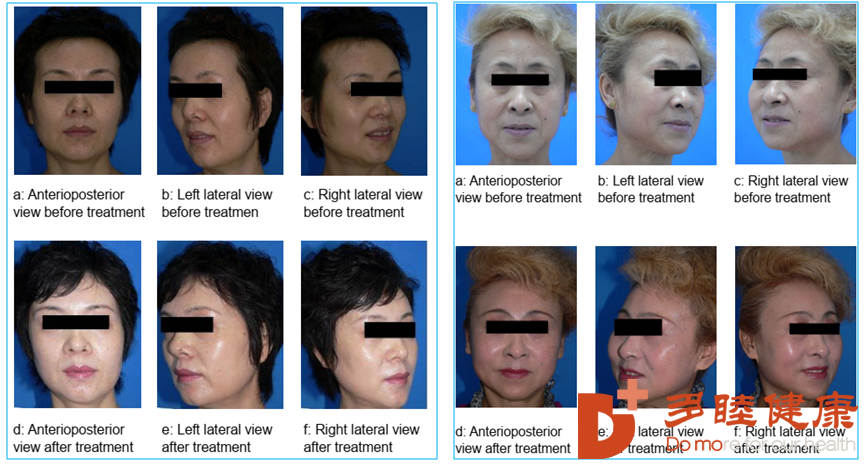
通过对45-65岁的6位面部拉皮候选对象,采用间充质干细胞抗衰改善后,研究发现,干细胞可以促进皮肤弹性纤维的再生,让皮肤更年轻化。
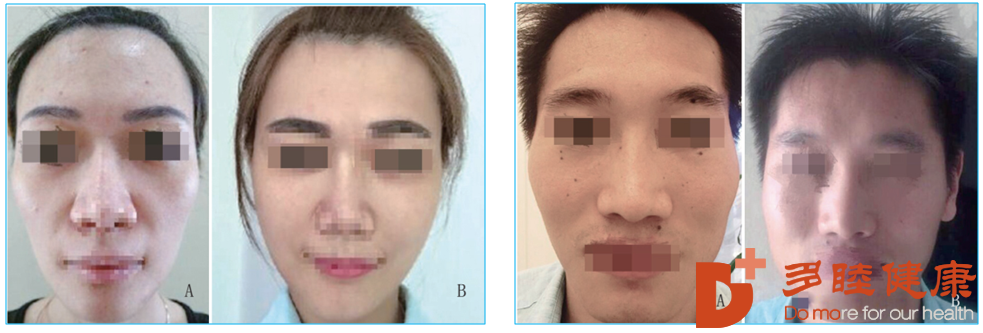
20例年龄在32-57岁的中年女性在接受了干细胞面部美容改善后,面部年轻化效果显著,皱纹、斑点、面部纹理都有所改善。
在平均年龄36.3岁的38例青年女性面部干细胞改善的案例中,间充质干细胞可以显著改善面部容颜及轮廓,是安全和理想的面部年轻化改善方式。
通过修复、更换衰老和受损的组织,修复基底细胞,让细胞恢复年轻的生理状态,使细胞更具持久青春活力,从内而外的击退色斑、抚平细纹、恢复肌肤柔软感,甚至达到美白亮肤的效果,这也是众多明星保持容颜“不能说的秘密”。
干细胞抗衰老
通过组织再生和修复的功能,干细胞可以防止面部皱纹及肌肤下垂问题,但这也只是停留在“皮肤护理”阶段,而精准的抗衰老必须是在干细胞技术对越来越多的疾病或亚健康状态能够解决的基础上的抗衰老。
通过静脉注射向身体输送健康活力的干细胞,使干细胞能够准确定植于细胞衰老部位,修复受损组织,还可通过分泌的细胞因子,调节免疫系统,从根本上恢复人体细胞活力,让人体保持更年轻活力的生命状态。

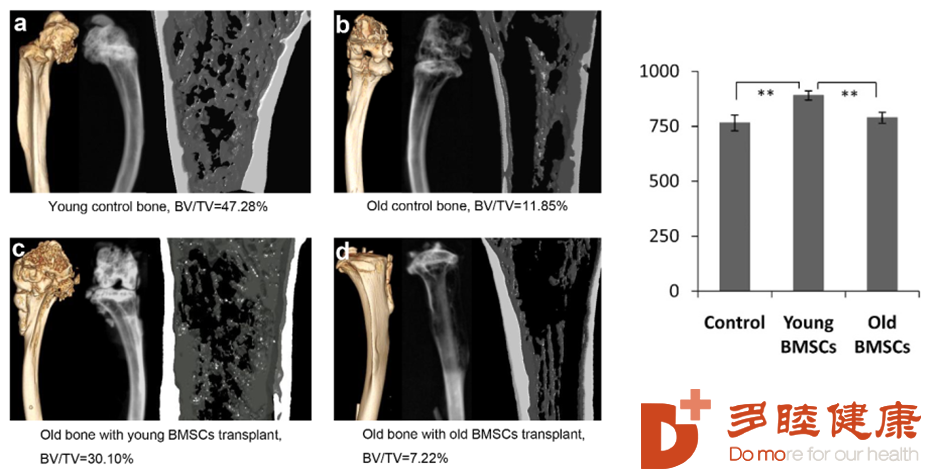
另一项实验,证实了干细胞通过修复结缔组织,对骨质疏松情况有所改善。实验通过对10只小鼠的对照,14只小鼠采用年轻的MSC注射,10只小鼠采用年老的MSC注射,结果发现,年轻的间充质干细胞可以改善小鼠骨质疏松情况,并提高了小鼠寿命。
干细胞还可以通过神经组织的修复,改善脑部功能。8只年轻大鼠对照,8只年老大鼠对照,8只年老大鼠MSC注射。
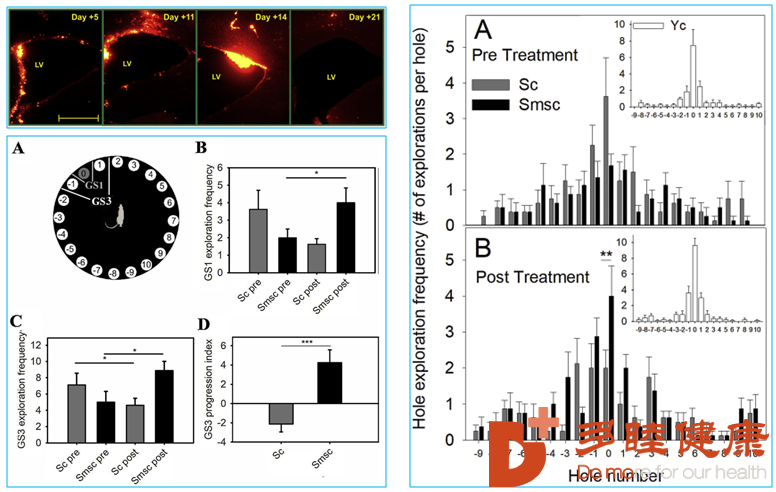
干细胞这颗生命的“种子”,它的强大功能正在改变我们的生活,而未来,干细胞还将带给我们更多畅想,让我们共同期待。
参考文献:
[1]Gu W, Hong X, Le Bras A, et al. Smooth muscle cells differentiated from mesenchymal stem cells are regulated by microRNAs and suitable for vascular tissue grafts[J]. J Biol Chem. 2018; 293(21):8089–8102.
[2] Xu R, Zhao H, Muhammad H, Dong M, Besenbacher F, Chen M. Dual-delivery of FGF-2/CTGF from Silk Fibroin/PLCL-PEO Coaxial Fibers Enhances MSC Proliferation and Fibrogenesis[J]. Sci Rep. 2017;7(1):8509. Published 2017 Aug 17
[3] Li Y, Cheng Q, Hu G, et al. Extracellular vesicles in mesenchymal stromal cells: A novel therapeutic strategy for stroke. Exp Ther Med. 2018;15(5):4067–4079.
[4]JIN SOO LEE, JI MAN HONG, GYEONG JOON MOON, etc. A Long-Term Follow-Up Study of Intravenous Autologous Mesenchymal Stem Cell Transplantation in Patients With Ischemic Stroke[J]. Stem Cells, 2010, 28:1099-1106.
[5]Nur SSA Halim, Wan M Aizat & Badrul H Yahaya. The effect of mesenchymal stem cell-secreted factors on airway epithelial repair[J]. Regenerative Medicine, 2019, 14(1):15-31.
本文链接地址:http://domo-kenkou.com/zixun/7157.html