常见眼部疾病还挺多,干细胞能治疗几类
[本文为疾病百科知识,仅供阅读] 发布日期:2019-09-26 阅读:1,538干细胞移植技术的发展为很多以往难以改善的疾病提供了治愈的可能性。近年来, 眼科研究者越来越重视干细胞移植技术的研究和应用 。干细胞疗法在眼表疾病的改善方面已经取得了一些研究成果。而对于其他眼部疾病 , 如黄斑变性 、糖尿病视网膜病变和遗传性视网膜变性 ,干细胞移植技术还面临着相当大的挑战。因此, 深入研究干细胞移植技术对于复杂眼科疾病的改善具有重要的意义。
1、角膜缘干细胞缺乏症使用干细胞改善
角膜缘干细胞缺乏症 (limbalstemcelldeficiency, LSCD)是指由于各种因素或病变导致角膜缘干细胞缺乏而引起的一系列眼部症状 。以前改善角膜疾病普遍采用的手段是角膜移植, 但是这种方法面临着慢性组织排斥反应 、角膜结构异常等问题 。通过干细胞移植来改善角膜疾病却能避免这些问题的发生, 成为一种新的改善选择。正常健全的角膜上皮是维持角膜生理功能的重要因素之一 。一般情况下, 干细胞可阻止结膜上皮侵入角膜。当各种损伤因素发生时 , 干细胞增生和分化功能受损,引起角膜上皮结构不能重建, 导致结膜上皮及血管翳移行修复角膜表面, 以致视功能下降 。角膜缘移植术是通过修补角膜缘组织缺损、恢复干细胞数量, 以达到重建眼表面的目的 。 Kenyon等已经证实角膜上皮干细胞在改善上皮边界缺失以及眼球表面损伤等疾病方面具有疗效。为了避免免疫排斥反应, 临床上多采用自体干细胞移植的方式来改善 LSCD。首先从患者正常眼或其亲属的眼取角膜缘上皮细胞切片, 然后在体外进行扩增培养 , 最终得到大量的角膜缘干细胞组织。 Rama等最近报道,在纤维蛋白上培养和扩增的角膜缘干细胞被成功移植到眼烧伤患者上, 大约 3/4患者恢复了视力。另外一种方法是绕过角膜干细胞本身, 用口腔黏膜上皮细胞作为角膜缘干细胞的替代来源。首先从患者口腔内提取黏膜上皮细胞切片 ,然后在体外人类羊膜上进行扩增培养。但是使用人类羊膜面临伦理挑战 ,而使用非人类培养细胞又可能出现免疫性问题。为此 , Higa等采用一种新的培养技术 , 采用纤维蛋白制作的培养基来扩增黏膜组织。尽管这种培养方式从免疫学角度具有吸引力, 然而 ,对于黏膜细胞在培养基上是否能长期生存并且是否具有再分化能力尚不明确。
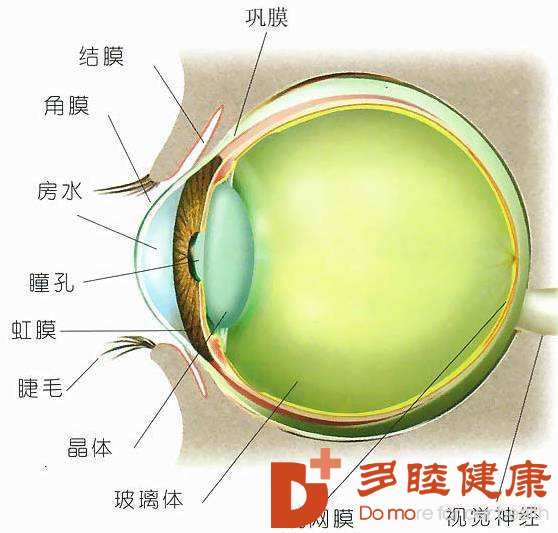
传统的观点认为 , 角膜缘是角膜干细胞的 “龛”。最近 ,来自几个实验室的报道对这一观点提出了质疑。 Majo等证实了在猪眼干细胞群不仅仅局限于角膜缘 ,甚至可以在整个眼球表面包括角膜上发现干细胞存在 。另外, 尽管自体角膜干细胞移植可以避免免疫排斥的问题, 但由于培养基细胞的不确定性 , 仍然存在着影响移植成功的免疫障碍。对于这种问题虽然可以通过使用人类自体血清和培养层细胞得到部分解决, 但是这种方法的培养效率还有待观察。
2、青光眼使用干细胞改善
青光眼是眼压调整功能发生障碍使眼压异常升高 ,因而产生视功能障碍, 并伴有视网膜形态学变化的疾病 。
传统改善青光眼的方法主要集中在如何减少眼内液生成以及针对睫状体和小梁的处理以便眼内液流出。青光眼患者同样可以从干细胞移植技术获得改善的方法 。 Kelley等报道 , 利用小梁干细胞移植技术使得眼内液得以流出 ,从而降低眼压。很早就有研究发现 ,原发性开角型青光眼发病的同时会伴有小梁组织细胞的大量减少。目前青光眼发病的确切病因尚不确定, 其中一种可能的机理是由于小梁细胞故障 阻碍了眼内液体的流出。 Acott 等。 从小梁祖细胞中发现了一种类干细胞群 ,并设想将这些细胞扩增培养后移植到青光眼患者的小梁上 。虽然后来 Gonzalez等 从人类小梁细胞中成功分离出这种类干细胞群, 但是这种细胞在表型上和成熟的小梁细胞存在差异。而这些细胞在临床上的应用还未见有相关的文献报道 。

既然青光眼最主要的影响在于神经节细胞的死亡 ,因此可以通过从各种祖细胞提取神经节细胞来替换受损伤的细胞 , 从而达到改善青光眼的目的。这种方法在生物学层面上虽然有很大的吸引力, 但它能否重新修复受损伤的包含神经节细胞的视神经纤维层尚是未知数, 因为理论上一直认为由于青光眼眼压升高所致的神经损害是不可逆转的 。尽管如此 ,科学家们仍在孜孜以求地探索着 。目前已经证实可以从胚胎干细胞和人工诱导干细胞中获得视网膜神经节细胞,这为视神经的修复提供了支持。由此可见,未来青光眼的干细胞改善前景还是令人鼓舞的 。
3、视网膜血管疾病使用干细胞改善
很多常见的致盲性眼疾都和视网膜血管异常有关 。这类疾病包括糖尿病视网膜病变 、早熟性视网膜病、黄斑毛细血管扩张和视网膜血管瘤增殖。局部血管网络和周围组织之间的协调对维持视网膜的生理平衡和功能具有重要的意义。事实上, 内皮细胞可以提供营养物质来刺激和引导神经干细胞的自我更新和分化。鉴于血管内皮细胞和周围组织的相互依存关系 , 有可能采用血管或神经祖细胞为组织提供旁分泌辅助功能 ,从而应对组织缺氧或基因编码特异性变性的危险情况 。这种改善方法一个很大的优点是避免了破坏性操作, 使得受损视网膜的修复和正常功能的维持变得容易。 Li等报道, 他们利用小分子诱导因子促使干细胞沿着特定路径分化 。这些新分化形成的细胞通过产生细胞因子、生长因子和营养分子,可以为受损细胞提供替换源或为受损组织提供旁分泌辅助功能。
可以用来修复视网膜血管损伤的干细胞有很多来源, 如骨髓细胞、人类脐血细胞等 。成人骨髓细胞含有丰富的造血干细胞 ,通过分化可以形成血管内皮祖细胞 (endothelialprogenitorcells, EPCs)和星形胶质细胞, 进而修复受损的血管 。 Chiou等研究发现源于骨髓细胞的 CD45细胞 (血型糖蛋白细胞)在体外同色素上皮细胞一起培养可以生成感光细胞群 。骨髓造血干细胞在信号因子的激励下可以产生 EPC,并且在眼受损处及缺血性周边血管准确定位到血管再生的位点。骨髓细胞中含有各种祖细胞,可以直接分化形成 EPC, 又可以形成其他促进旁分泌功能及保持血管内皮稳定的细胞 。但是这些细胞是否能够促进血管正常化或者改善缺氧性血管损伤目前还有很大争论。 Elsheikh等 认为 EPC 具有与单核细胞类似的功能 ,在血管形成的早期发挥一定的作用。而在血管形成的后期, 这些细胞主要发挥旁分泌的功能 , 激发其他类型的血管祖细胞的产生 。对于骨髓细胞的作用机理, 同时存在着另外一种观点。 Ritter等研究发现, 骨髓细胞对新生血管的形成有直接的调节作用 ,而不需要通过生成 EPC来体现这种作用 。 Higashi等在小鼠实验中证实 ,骨髓祖细胞可以恢复和维持缺血或缺氧性受损血管的功能 ,并能避免血管畸形现象的发生。

4、视网膜神经退行性疾病的干细胞改善
视网膜血管性疾病主要病变部位在血管, 随后才会进展到神经部位 。而视网膜神经退行性疾病则直接导致神经病变 , 主要表现为对光感受器和视网膜色素上皮 (retinalpigmentepithelium, RPE)细胞的功能损伤。年龄相关性黄斑变性 (age-relatedmaculardegeneration, AMD)是最常见的神经退行性眼疾 , 其发病原因主要与黄斑区长期慢性光损伤及 RPE细胞老化有关 。既然视网膜神经退化疾病都存在感光细胞及 RPE细胞的丢失,常规的药物改善缺乏疗效 , 因此目前相对理想的改善方法可以通过干细胞移植来修复 、补充或替代这两类丢失的细胞。实验表明神经祖细胞对光感受器细胞的修复可以起到一定的作用。这一作用是通过神经祖细胞释放神经营养因子实现的 , 并且可以通过转基因的方式来过度表达释放营养因子, 使这一作用得到加强。这个发现提出了一个有趣的设想 ,即干细胞或许可以作为运输载体将药物送到视网膜上 ,从而达到靶向改善的效果。
与传统改善手段相比 , 干细胞移植技术在眼表重建和视网膜疾病的改善上具备相当大的潜力, 有关这方面的研究也已经取得了一些有益的成果 。但是,目前干细胞移植的研究大多还处于理论阶段 ,要将这些成果应用于临床尚需时日 ,还有待进一步解决现存的一些问题, 比如免疫排斥反应 、干细胞致瘤风险等 。另外, 眼部干细胞目前还缺乏明确的标记和分类 ,对干细胞的生长和扩增的深层次机理尚缺乏认识 ,微环境对干细胞分化路径的调控机制还没有明确的结论。因此, 要充分发挥干细胞移植技术在眼科疾病改善中的作用 ,需要从理论以及临床上进一步深入地研究和探索 。
本文链接地址:http://domo-kenkou.com/gxbzs/2162.html










