干细胞治疗:“冠状病毒”诱发重症肺炎的重要治疗手段
[本文为疾病百科知识,仅供阅读] 发布日期:2020-01-31 阅读:1,5202003年一种冠状病毒引起SARS大流行,2020年另一种冠状病毒(2019-nCoV)在武汉爆发,牵动着全国人民的心。现代医学发展至今,除了少数几种病毒能被研究者成功开发疫苗,面对绝大部分病毒感染依然是束手无策。面对2019-nCoV新型冠状病毒引起的重症肺炎,间充质干细胞(MSC)能否帮上忙,协同改善重症肺炎?
临床研究已经发现了MSC成为改善人类免疫缺陷病毒(HIV)免疫异常、乙型肝炎病毒(HBV)慢性肝炎、流感病毒急性肺损伤(ALI)等病毒相关疾病的有效工具。MSC能否协同改善2019-nCoV新型冠状病毒引起的重症肺炎?这个问题需要从多个维度来讨论和论证。
1,冠状病毒引起的重症肺炎
首先,如果冠状病毒引起的轻度肺炎,是不需要干预改善的,人体具有一定的自愈能力。需要改善的是冠状病毒引起的重症肺炎。
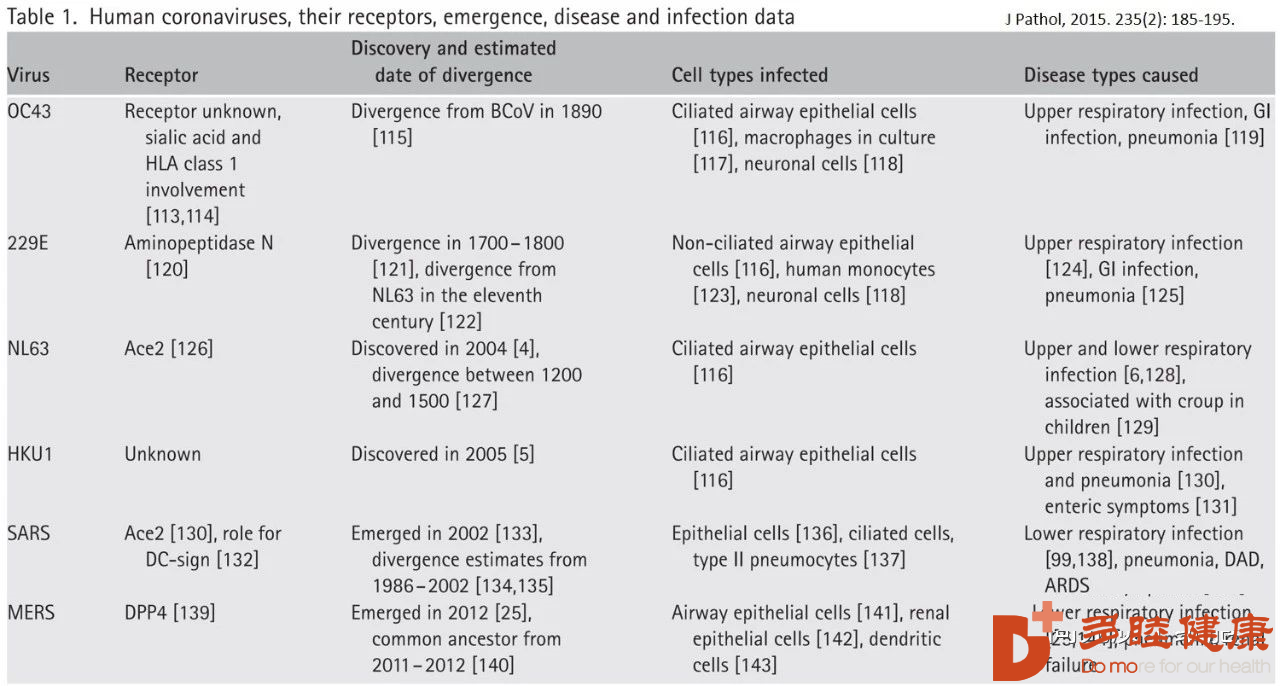
临床上不同人类冠状病毒的致病特点:
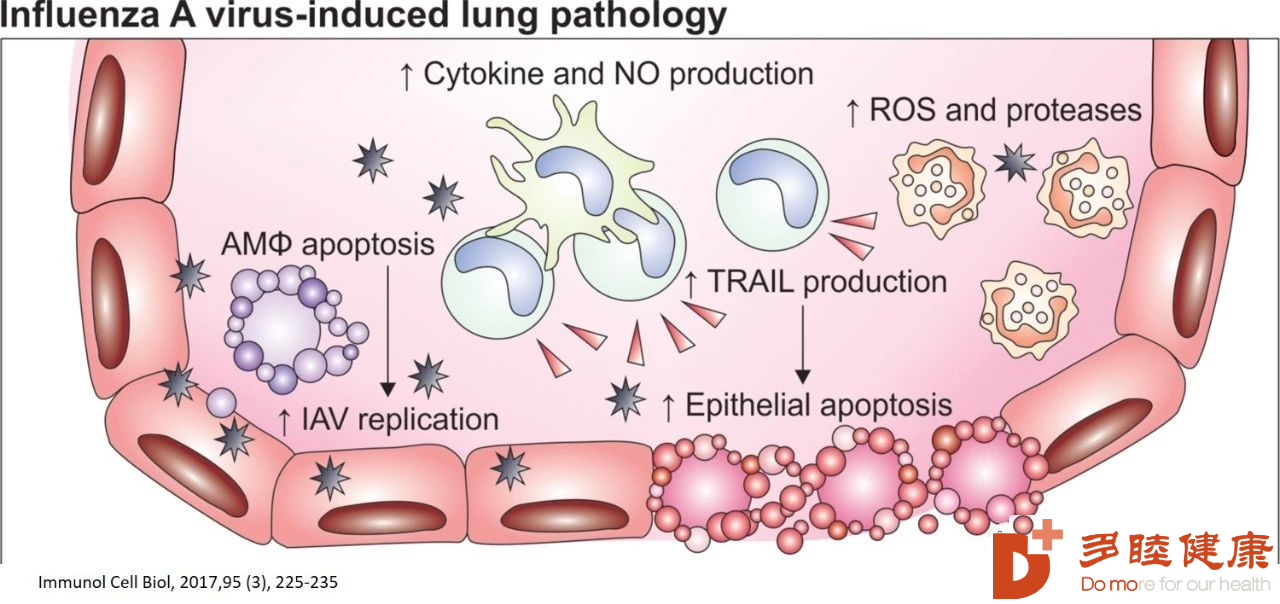
严重急性呼吸综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV)通过高细胞分裂素血症和侵袭性炎症的机制,出现了病毒快速复制、大量炎性细胞浸润和促炎细胞因子/趋化因子反应升高,导致致命的急性肺损伤(ALI) [1, 2]。SARS冠状病毒引起肺损伤和炎症的部分原因是通过肾素血管紧张素途径的作用[3]。SARS冠状病毒通过人血管紧张素转换酶2(HACE2)感染人气道上皮细胞(HAE)细胞,hACE2是SARS冠状病毒进入HAE纤毛细胞的主要受体[4]。最终死于SARS的患者表现出肺促炎堆积,而出现了促进伤口愈合的巨噬细胞的缺失[2]。
人类和动物的研究都表明,在人类冠状病毒感染后,炎性单核细胞-巨噬细胞和中性粒细胞在肺部积聚。这些细胞是人类冠状病毒致死性疾病相关的细胞因子和趋化因子的主要来源[5, 6]。病毒的快速复制和旺盛的促炎细胞因子/趋化因子反应的最早后果之一是肺上皮细胞和内皮细胞凋亡;上皮细胞和内皮细胞的凋亡破坏了肺微血管和肺泡上皮细胞屏障,导致血管渗漏和肺泡水肿,最终导致缺氧[7-9]。
肺部巨噬细胞的功能和表型可能会随着其极化状态的不同而变化,这取决于细胞因子环境[10, 11]。病毒损伤肺细胞,吸引了巨噬细胞的聚集,巨噬细胞试图消除炎症。但是,病毒的快速复制和大量破坏肺细胞,过激的炎症环境反而诱导M1型极化,从而加剧了肺部炎症。
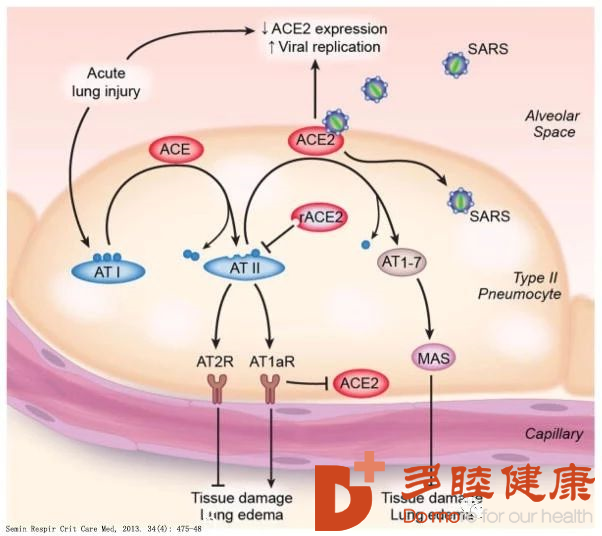
在正常情况下,凋亡细胞会被常驻吞噬细胞悄悄清除,而不会引起炎症。相反,急性组织损伤通常伴随着炎症,即使在非免疫性或非感染性损伤的情况下也是如此[12, 13]。坏死细胞释放的细胞成分和微血管损伤导致血管通透性增强,巨噬细胞和中性粒细胞浸润。SARS患者肺泡巨噬细胞(AM)和CD8+T细胞增多;而SARS恢复期部分患者肺炎消退延迟,可能与冠状病毒清除延迟有关[14]。重要的是,坏死细胞的吞噬作用会导致促炎因子的释放,如肿瘤坏死因子-α、白细胞介素-1、各种趋化因子和白三烯,以及自由基[17]。
包括B细胞、CD4+T细胞和CD8+T细胞在内的获得性免疫细胞也与组织损伤和修复密切相关[15, 16]。冠状病毒特异性T细胞对于病毒清除和限制对宿主的进一步损害至关重要[19]。此外,T细胞反应也会抑制过度活跃的先天免疫反应[20, 21]。致病性人类CoV引起的旺盛的炎症反应减弱了T细胞的反应,在SARS-CoV感染的情况下,通过TNF介导的T细胞凋亡,从而导致失控的炎症反应[1]。
2,MSC能否被病毒感染?
(1),疱疹病毒
疱疹病毒包括巨细胞病毒(CMV)、单纯疱疹病毒-1(HSV-1)和单纯疱疹病毒-2(HSV-2)、爱泼斯坦-巴尔病毒(EBV)和水痘带状疱疹病毒(VZV),是免疫受损宿主的主要病原体[22]。人巨细胞病毒通过改变骨髓MSC的细胞表面分子库,从而改变了骨髓MSC与造血干细胞之间的相互作用模式;巨细胞病毒还损害MSC的成脂和成骨分化过程[23]。最近的一项研究表明,CMV感染通过减少IDO的表达,严重损害了MSC介导的免疫抑制功能[24]。来自骨髓的MSC对CMV感染很敏感,在19例人CMV血清阳性的健康成人中分离的7例骨髓的MSC中检测到低拷贝数的人CMV-DNA[25]。卡波西肉瘤相关疱疹病毒(KSHV)可以感染人类胎儿MSC,但不能使这些细胞永生和转化[26]。
胎儿膜源性间充质干细胞(FM-MSC)可以被HSV-1、HSV-2和VZV感染,但不会感染EBV和人类疱疹病毒6、7和8(HHV-6、HHV-7和HHV-8)感染;这些病毒能够进入FM-MSC,但是由于病毒基因表达受限,并没有发生生产性感染[27]。
在从18名骨关节炎(OA)患者和10名健康人中分离和培养骨髓MSC;18名OA患者骨髓MSC中总病毒DNA检出率为16.7%(3/18),其中有1人B19(病毒载量,61.2拷贝/微克DNA)阳性,2人VZV(平均病毒载量,14.4拷贝/微克DNA)阳性,没有人感染HHV-6;健康人骨髓MSC的总病毒DNA检出率为20%(2/10),在患者和对照组之间没有统计学上的显著差异[28]。这也说明人群中普遍存在各种病毒的感染(携带者)。
(2),细小病毒
20例健康供者骨髓MSC中有1例含有细小病毒B19的DNA。骨髓MSC表达B19受体(P抗原/球蛋白)和辅受体(Ku-80),并能在体外将B19传递给骨髓细胞,提示病毒可以在健康人的骨髓基质中持续存在[29]。不过,两名接受造血干细胞移植的患者接受了B19阳性的MSC作为移植物抗宿主病的改善,既没有出现病毒血症,也没有出现症状的B19感染[29]。
(3),HIV
HIV-1的发病特点是CD4+T细胞逐渐耗尽,最终导致临床上的免疫缺陷。在HIV感染的高效抗逆转录病毒疗法(HAART)改善的非免疫反应者(NIRS)中,MSC被认为能够通过降低CD8+T细胞的激活来改善宿主免疫重建的结果,这可能导致更有效的CD4+T细胞恢复[30, 31]。HIV蛋白TAT和Nef可以通过增强炎症或减少自噬来诱导MSC衰老,从而减少可用的成骨祖细胞的数量[32]。这也解释了与非HIV感染者相比,HIV感染者的骨密度较低,骨量减少/骨质疏松的患病率较高的现象。
HIV-1感染可以抑制骨髓MSC的克隆形成能力,增加促炎细胞因子(TNF-
本文链接地址:http://domo-kenkou.com/gxbzs/4440.html