细胞移植修复椎间盘的新视角与新进展
[本文为疾病百科知识,仅供阅读] 发布日期:2019-10-18 阅读:2,091目前对椎间盘退变的改善仅限于姑息改善或积极的外科干预,但均不能减缓或逆转其进程,远期疗效也不满意。近年来随着组织工程与再生医学的不断发展,运用细胞疗法修复退变椎间盘得到了越来越多的研究者关注。
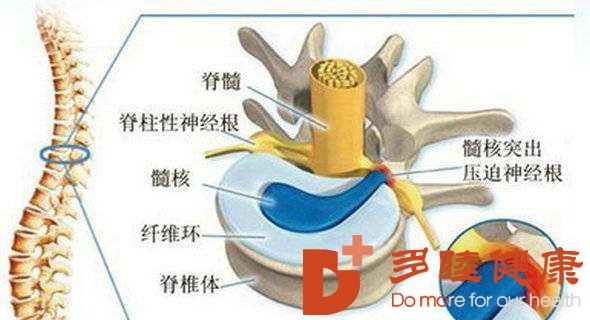
椎间盘是位于骨性椎体之间的纤维软骨组织体,中心为亲水性凝胶状的髓核,被径向排列紧密、厚层的胶原纤维环包围。髓核有持续更新细胞外基质的能力,从而建立了高静水压力的微环境,这使得椎间盘能够负荷超高的压缩力,同时能够使嵴柱灵活的活动。纤维环细胞在形态学上类似于成纤维细胞,以分泌胶原纤维为主,在嵴柱伸、屈、扭转活动时承受牵张应力。椎间盘各部分所含细胞种类不同,成年人髓核的主要成分是类软骨细胞,它能合成蛋白多糖和Ⅱ型纤维蛋白;纤维环主要含有类纤维母细胞,其合成Ⅰ型纤维蛋白。椎间盘退变是椎体自然老化、退化的生理病理过程。
目前认为髓核是发病的起源,其在椎间盘退变的早期阶段就显示出明显的变化,出现大部分髓核细胞衰老,细胞活力下降。椎间盘退变的主要特征包括椎间盘内细胞数量减少和功能降低,以及蛋白多糖和细胞外基质成分减少,进而导致椎间盘水含量降低,胶原纤维逐渐溶解,髓核从纤维软骨组织变为更硬的纤维化结构,这些结构变化改变了嵴柱的生物力学特性,影响相邻椎骨并可能诱发小关节炎、骨刺形成和促进嵴柱相关疾病,例如椎管狭窄症、腰椎滑脱和嵴柱后凸。生理结构上,椎间盘组织处于高机械强度、高渗透压、低营养、低氧的微环境中,随着年龄的增加,极易发生退变。椎间盘退变最常见的表现是腰背部和颈部疼痛,二者是目前医患需要应对的难题。
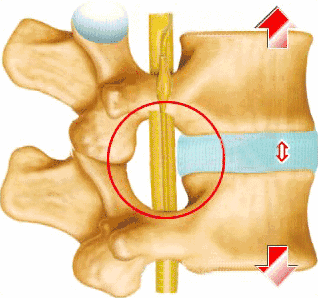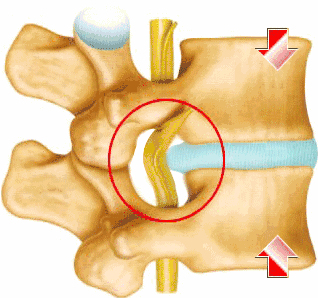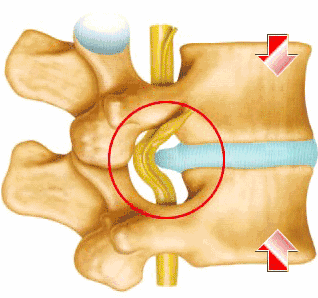
目前主流的改善方法仍然是预防和姑息性改善,例如物理改善和止痛药的对症改善;对于症状较严重的患者,临床上常用的改善方法是内镜下椎间盘切除及椎体融合,疗效是确切的,但却没有保存椎间盘的生物学功能,甚至增加了椎间盘的负荷。因此,人们对细胞改善恢复和逆转椎间盘活动方面的方法产生了极大的兴趣。
固有再生
椎间盘退行性变的特征表现为失活细胞数的增加和细胞衰老速度加快。椎间盘祖细胞也随着年龄的增长而减少。大多数组织受到损伤时,都具有让周边新的、活跃的细胞向损伤组织趋化和迁移的能力,从而使受损组织得以再生。
细胞来源
椎间盘的髓核细胞处于高渗、酸性、低糖和低氧的环境中而缺乏血液供应,特殊的生存环境决定了髓核细胞与其他细胞的特性明显不同,髓核细胞持续表达缺氧诱导因子1α,在不同氧气体积分数的条件下缺氧诱导因子1α都能诱导髓核细胞适应糖酵解,使髓核细胞能够很好地利用有限的营养物质进行生存,同时缺氧诱导因子1α促进了髓核特异性细胞外基质的产生。由于髓核细胞与软骨细胞的免疫表型及分子标记相同,能向类软骨细胞分化的细胞就被认为是椎间盘再生可能的候选细胞。干细胞成为近年来许多研究者用来促进椎间盘再生的首选细胞。
自体细胞移植具有最低的免疫原性反应,但是这种方法通常受时间的限制,同时需要昂贵的细胞扩增、分化费用,此外体外培养有可能增加感染的概率。有研究人员支持同种异体或异种移植,他们通过椎间盘内部的无血管的性质而认为椎间盘内部组织是无免疫保护的。
临床报告
椎间盘中细胞增殖的潜力有限,许多研究都围绕如何将外源性细胞移植到椎间盘中对其进行修复,这些被移植的细胞可以与椎间盘内的细胞原位结合,不仅有助于产生新的基质而且也可以通过分泌相关因子刺激受体椎间盘细胞分化增殖。德国和奥地利的研究人员联合多中心实验评估了细胞移植改善的疗效,2组患者分为椎间盘切除术组和椎间盘切除术后细胞移植组,与仅椎间盘切除术组相比,细胞移植组术后疼痛的临床评分显着降低,2年随访中观察到细胞移植组邻近椎间盘的含水量得到改善,2组椎间盘的高度指数没有显着性差异。
临床前阶段和临床结果阶段表明椎间盘细胞改善的潜力。在该综述中,所有应用骨髓来源间充质干细胞或软骨细胞样细胞的研究都报道了延缓或逆转椎间盘退变,以及疼痛减轻、残疾减少和改善的影像学特征。但是,移植的细胞是否能够诱导或促成新的基质产生仍然不确定。目前,对潜在基质再生的诊断方法是有限的。因此,非常需要新的创新和标准化方法。此外,安慰剂对照研究用于确认疼痛和残疾减少的有效性也是必要的。同种异体移植没有发现免疫原性反应相关不良反应,说明包括同种异体移植等细胞移植是一种安全的方法,并支持了椎间盘是免疫特权组织的概念。
细胞疗法弥补了现代姑息疗法和积极外科改善之间的鸿沟。通过对精心设计的临床试验研究可以发现,细胞疗法作为改善椎间盘变性的新方法具有巨大的潜力,能够对椎间盘退变的发病及修复机制有更为详尽的认识,更能够对其他相关疾病的预防与细胞改善提供新的思路与策略。
本文链接地址:http://domo-kenkou.com/gxbzs/gjy/2235.html